【國醫青年說】創新中藥國際化研發的體會和思考 ——訪天士力研究院執行副院長周水平研究員(圖)

周水平
醫學博士、研究員,博士畢業于北京中醫藥大學。現任天士力控股集團研究院執行副院長,中國藥科大學、沈陽藥科大學校外導師;先后主持98個新藥項目研發,獲得6個新藥證書/生產批件、15個新藥臨床批件;作為發明人,先后申請發明專利205件(PCT73項),獲得授權75件(PCT24項);先后主持或參與15項國家及省部級課題,發表專業論文109篇,其中SCI文章19篇、專著4部;獲得國家科學技術進步二等獎1項、省部級一等獎3項、二等獎1項。
加強中醫藥的科技創新并實現其現代化和國際化,是我國從1996年倡導中藥現代化戰略行動以來一直堅持的基本國策和目標,近年來,在國家“一帶一路”戰略引領下,以《國家中長期科學和技術發展綱要(2006-2020年)》、《中醫藥事業發展“十二五”規劃》、《中醫藥創新發展規劃綱要(2016-2030年)》等一系列指導性產業政策和文件的頒布和出臺為標志,為扶持我國創新中藥國際化研發提供了良好的環境和氛圍。
提問一:請您簡要介紹一下創新中藥國際化的模式和成果
面對疾病譜演變、醫學模式變化以及國際新藥生產力下降等現狀,植物藥已經成為了全球創新藥物研發的重要源泉,除傳統的從植物中發現單體活性成分并進行結構修飾/優化以獲得新藥這一途徑外,定位于多種已知或未知活性成分的混合物作為新藥進行創新研發,也成為國際制藥行業近年來新藥研發的重要途徑和選擇。 具有多組分多靶點治療特點的中藥,因其整體性治療法則恰好適合了現代醫學的需要。
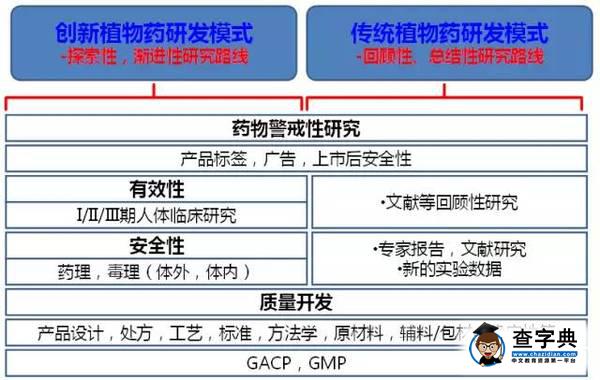
不同于從早期新分子實體篩選/合成/修飾到臨床有效性評價的西藥研發模式,基于中藥安全性和有效性數據,通過全面的追溯和回顧性研究而進行反向藥物開發并最終實現上市,這一研發模式在美國FDA的植物藥工業指南的實施精神中得到充分體現。
目前,以中醫理論為基礎具有人用經驗的創新中藥,其國際化研發可以分為兩種模式:
第一種是以美國FDA為代表的漸進性、創新式的開發,基于中藥的傳統人用經驗,創新中藥可從人體臨床研究重新起步,在產品開發過程中,根據研發需要進行逆向式的藥理毒理和臨床研究,獲得批準和上市。
第二種是以歐盟傳統藥申請為代表的回顧性的研究,基于該品種或相似品種充足的人用經驗和文獻證據的評價結果,研發品種具備了產品免除大部分臨床和臨床研究的條件,通過完整的質量開發,就能滿足此類中藥產品獲得批準和上市。
就歐美發達國家而言,目前正在申報美國FDA開展臨床研究的中藥品種已經超過了十個,復方丹參滴丸已順利完成Ⅲ期臨床,現進入COV(臨床中心關閉訪查)階段;扶正化瘀片、血脂康、康萊特注射液、HMPL-004(穿心蓮提取物)等已完成Ⅱ期臨床。同時,中藥產品地奧心血康和丹參膠囊也已在荷蘭的先后成功注冊,表明了歐盟藥審局已開始正式接納中藥合法進入醫藥市場。
國際化研發模式比較
提問二:選擇哪些中藥品種進行國際化研發更有可行性呢?
以FDA申報為例,走在國際化前列的藥物有這樣一些共同點:
①為國內已上市多年的產品,多為中藥大品種。臨床應用經驗豐富,安全性和有效性得到充分驗證,不良反應信息較為全面。因此,得到FDA批準進行臨床試驗的可能性大。
②豐富的文獻支持資料,包括臨床前和臨床研究文獻,能為臨床獲批提供更多支持數據。如,CNKI中可搜索到接近2萬條復方丹參滴丸相關文獻。
③除2015年新獲批Ⅱ期臨床的連花清瘟膠囊為13味大復方外,其他藥品組方相對簡單,為1-6味藥材組成,在提供符合法規要求的CMC資料上面臨的挑戰相對小。
④除康萊特注射液外,其余均為口服劑型。而康萊特注射液僅含單一藥材提取物,組分相對簡單,相較而言更容易實現良好的藥品質量控制。
故而,我們的策略與建議是:
人用經驗豐富的中藥品種,國際申報開展Ⅱ期研究,同時根據法規要求補充I期或毒理資料;
缺乏人用經驗而在臨床前研究有潛力的品種,可國內國際同步申請IND,國際申報開展I期研究,國內申報走加快審批途徑。
而就中藥品種歐盟申報而言,符合性申請有嚴格的限定條件:包括劑型(只能口服、外用和噴霧劑型),適應癥(OTC用途),傳統年限(15/30年)等。基于法規定義, 中藥產品應作為OTC產品,即患者不需醫生監督可自行使用。歐盟法規要求的“15/30年應用”,在可以減免臨床研究的基礎上,通過多重證據鏈證實產品的安全性/有效性是解決問題的關鍵。同時,通過增補遺傳毒性研究和藥物上市后警戒性等額外的臨床安全性數據,也是中藥研發中要考慮的一個方面。
提問三:關于創新中藥的國際化,可否分享一下您所在企業的成功經驗?
那我從CMC研究、藥理毒理研究、臨床研究三個方面簡要介紹一下吧:
(一)CMC研究
CMC研究是新藥申請(NDA)的必要、關鍵環節。美國FDA、歐盟EMA均要求以正確的工藝及配套驗證方法,精準執行,且驗證貫穿始終,以確保生產、質量控制及技術研究體系達到法規水平。
目前中藥國際化研發CMC的瓶頸在于:如何以物質基礎研究和組分證明有效性、如何進行中藥質量一致性評價、如何進行藥品全生命周期的質量管理。
我的建議是,全產業鏈必須建立多組分藥物質量控制標準體系:
①提倡質量源于設計:貫徹“質量源于設計(QbD)”的理念,按照ICH和FDA的指南,將藥品的生產質量控制體系在研發階段就予以設計并確認。
②基于質量風險管理:本著“基于風險”和“基于科學”兩大原則,項目中的工藝變更、標準變更和設備設施的變更,都要有利于降低產品質量風險。關鍵質量屬性(CQA)和關鍵工藝參數(CPP)的確定,也要基于工藝過程的風險分析。
③強化過程控制:藥材、輔料、內外包裝材料以及工藝過程中所用溶劑和物料,在基于風險評估基礎上,采用全面質量控制,達到法規要求。
④實施全面驗證:按照產品生命周期設計進行驗證,從“紙工廠”到新車間建設運行,技術轉移及工藝驗證覆蓋各個專項工作,對工作標準和邏輯性進行嚴格控制。
⑤遵循國際標準:按照FDA、歐盟、ICH、ISPE(國際制藥工程協會)等國際化標準和指南,從臨床樣品生產階段,就全面實施cGMP質量管理。
⑥從源頭保障藥材質量:將道地藥材與數字科技相融合,從中藥材交易、中藥材第三方檢測和產品溯源三大核心方面,按國際化要求倒逼藥材質量提升。
(二)藥理毒理研究
①熟悉FDA關注點,合理布局藥理毒理研究:FDA對于植物藥藥理毒理研究采取分階段申報原則,IND及早期臨床階段,FDA對于已上市且無不安全報道的植物產品相關非臨床藥理毒理研究要求不高,提供文獻支持以及早期的GLP或非GLP毒理研究均可以。在進入Ⅲ期臨床及NDA階段,需要補齊相關毒理研究,包括安全藥理、遺傳毒性、DDI、非嚙齒動物重復給藥毒性、生殖毒性以及致癌性研究。
②FDA對藥用輔料非臨床安全性研究是非常重視,如含有新藥用輔料,均需要提供新輔料支持性毒性研究。
③除規定在GLP實驗室完成毒理研究實驗,FDA對遺傳毒、生殖毒、致癌性、輔料毒性以及毒理研究中的供試品分析和毒代研究要求較國內更為關注和嚴格;重視程度與化學藥相同。
④參考ICH和FDA相關指南,在重復劑量毒性研究、遺傳毒性研究、生殖毒性試驗、致癌性試驗均需要伴隨TK研究。對于復雜成分中藥,TK markers的選取及方法建立可采取遵循毒性成分及代謝產物、其次主要活性成分及其代謝產物、再則典型可測/易測的成分等逐層考慮原則。
⑤由于中藥組分復雜性的特點,其提取物整體作為活性物質,不能簡單按照化學藥成分控制的質量評價方法,也不能通過BE研究去評價工藝改進等對中藥產品質量的影響。FDA對中藥的質量一致性評價提出更多的要求:即含有多成分及未能闡述清楚所有成分的植物藥申報時均建議開發基于臨床療效機制的生物效價(Biological assay)方法用于中藥產品質量一致性評價。
(三)臨床研究
①適應癥選擇
如何選擇適應癥,是創新中藥國際化臨床研究的關鍵問題之一,直接決定其有效性評價。 定位于國內市場的中藥品種,其適應癥多為中醫證侯。在國際化的臨床研究中,需要選擇基于西方醫學理論的明確疾病或癥狀作為適應癥。
西醫依據身體系統、發病機制、病理改變、臨床表現、疾病所處階段等對于疾病有著非常詳細的劃分,每一種疾病又根據其臨床特點進行進一步分類,有不同的治療方案。中藥在選擇適應癥時必須以此為依據。同時需要關注到,疾病常有發展轉歸,在不同階段有不同特點及相應的治療方案。對于相關疾病,需要明確治療階段。
中醫的特點之一為成分復雜、多靶點起效,不同于西醫成分單一、靶點明確、作用迅速的特點。在適應癥的選擇上,需要結合中藥以及疾病特點進行充分評估。對于已有良好治療方案的疾病、危重疾病或中醫沒有確切療效的疾病等需審慎選擇。此類疾病不僅有較大倫理風險,也很難在臨床試驗中顯示出較好療效。
②臨床方案設計
中藥國際臨床試驗的整個過程,是在了解中藥基本特性的基礎上,提出問題(試驗目的),通過科學方法(方案設計符合GCP的試驗過程)尋求答案和得到驗證的逐步深入的過程。中藥國際臨床研發是一個循序漸進的過程,從小規模的前期試驗獲知藥物的基本特性,到后續大規模的確證性試驗,臨床研發計劃、目標設定和階段性評估非常重要,有助于及時調整研發策略,減低研發風險。
臨床研究質量源于頂層設計,計量統計藥理學方法的應用在方案設計中發揮重要作用。給藥劑量與劑量跨度,不同的給藥方案,病人的群屬、年齡和基礎值,藥效學峰谷效應因素,治療周期、基礎用藥、合并用藥,病人依從性等因素均需要科學綜合考慮。
簡而言之,科學合理的臨床試驗方案設計是試驗成功的基礎,符合GCP和ICH要求的臨床試驗是通向成功的階梯,嚴謹的數據管理是評價藥物安全性及有效性的保證。
③充分掌握藥政法規
例如,SPA是FDA與企業就重大或創新性研究設立的一個特別法規程序。FDA與企業達成SPA共識后,即成為雙方共同遵守的約定,在新藥評審(NDA)時,將不再對達成共識的研究方案提出疑義。
另外,充分使用罕見病產品的相關的孤兒藥認定、罕見病產品資助等政策;優先審評、快速通道、突破性療法等可能的審批途徑。
提問四:您對有志于中藥國際化研發的企業還有哪些建議?
目前,我國沖擊歐美發達國家醫藥市場的中藥品種不斷增多,但多為各品種、各企業間的單打獨斗,在全行業范圍內缺乏可以在一定程度上互相交流和共享的協調體系,類似行業協會的功能需要加強,為后續項目提供可供借鑒的研究經驗和通路,形成足夠的產業引導效應。
多數企業參與現代化國際化的意愿和熱情很高,但在具體操作層面上,由于缺乏頂層設計和輔導,一些企業的現代化和國際化戰略定位不清晰,風險考慮不周全,實施過程不科學,導致部分國際化品種在進展到某一階段后,易于遭遇不必要的挫折而止步。
建議有志于中藥國際化研發的企業與有豐富臨床試驗開展經驗的國際CRO合作,尋求專家對于試驗設計和臨床開發方案的建議,選擇合格CRO監察臨床研究開展的GCP符合性、數據管理,確保合格臨床研究報告的撰寫及與藥政部門更有效的溝通。
概而言之,創新中藥國際化研發是一項宏偉的系統工程,以上建議難免掛一漏萬。中藥企業需考慮科研、產業、市場、資本等要素的分配,具體可參考閆凱鏡博士提出的MITRO模型即“市場為導向、產業為基礎、科技為引領、法規為準繩、組織為保障”,進行集成研究。
從外部環境而言,FDA、EMA也在逐步完善其對植物藥的監管和開發指南,這些進步都足以看到中醫藥的認可程度在逐步提高;同時國家對中藥國際化的鼓勵政策也一直在逐步建立和實施。相信未來將有更多優秀的中藥企業將勇敢地踏上國際化征程,為中藥這一華夏瑰寶造福世界而努力。
作者|周水平
技術|何思航
更多精彩資訊請關注查字典資訊網,我們將持續為您更新最新資訊!