重慶教師公招化學教師招聘考試試題以及解答
第一題(12分)化學家們自19世紀以后陸續發現,有一些化學反應中的某些組分或中間產物的濃度能夠隨時間發生有序的周期性變化,即所謂的化學振蕩現象。蘇聯化學家Belousov B P和Zhabotinsky A M最早發現了均相條件下的化學振蕩現象,后人稱他們發現的化學振蕩為B-Z振蕩。下面是一種B-Z振蕩:在含有硫酸鈰(III)催化劑和Br-的溶液中,用BrO3-氧化丙二酸,可以看到溶液由無色變黃,一會兒又變為無色,如此振蕩。反應機理為:第一階段:當溶液中Br-濃度較高時,Br-與BrO3-在酸性條件下生成Br2,后者立即與丙二酸發生一取代反應。第二階段:當Br-濃度較小時,反應切換到此階段,即BrO3-氧化Ce3+到Ce4+,本身被還原為HOBr。第三階段:Br-再生,并把丙二酸徹底氧化。分別寫出三個階段的總反應式: 第一階段:BrO3-+2Br-+3H++3CH2(COOH)2===3BrCH(COOH)2+3H2O(3分)第二階段:BrO3-+4Ce3++5H+===HOBr+4Ce4++2H2O(3分) 第三階段:HOBr+4Ce4++BrCH(COOH)2===2Br-+4Ce3++3CO2(g)+6H+(3分)反應究竟在哪個階段,是由Br-的濃度(2分,不點出濃度扣1分)決定的。使溶液呈現黃色的物質是:Ce4+(1分)
第二題(9分)某無色溶液其中可能存在Na+、Ba2+、AlO2-、S2-、SO32-、SO42-。取該溶液進行有關實驗,實驗結果如下圖所示:(暫缺) 請回答:1、沉淀甲的化學式為S(2分)。2、由溶液甲生成沉淀乙的離子方程式為Al3++3HCO3-==Al(OH)3(s)+3CO2(g)(2分)。3、沉淀丙中一定含有BaCO3(1分)可能含有BaSO4(1分)。4、綜合上述信息,該溶液中肯定存在的離子有:Na+、AlO2-、S2-、SO32(Na+2分,其它離子一個1分,因溶液中不可能只有陰離子,漏寫扣對應分數,但多寫一個給0分)。(3分) 第三題、(9分)1964年Eaton和Cole報道了一種稱為立方烷的化合物,它的分子式為C8H8,核磁共振譜表明其中的碳原子和氫原子的化學環境均無差別。若用四個重氫(氘)原子取代氫原子而保持碳架不變,則得到的四氘立方烷C8H4D4有異構體。 1)用簡圖畫C8H4D4的所有立體異構體,并用編號法表明是如何得出這些異構體的。給出異構體的總數。(每個1分) C8H4D4有7個異構體。(暫缺) 2)用五個氘原子取代立方烷分子里的氫原子得到五氘立方烷C8H3D5,其異構體有多少個?(2分) C8H3D5有3個異構體,(其中有2對映異構體)。 第四題(15分) 聚合硫酸鐵(PFS)是一種新型高效的無機高分子絮沉劑,廣泛用于水的處理,通常用鐵的氧化物來制備它。其制備過程如下:(暫缺) 試回答下列問題: 4-1、 Ⅱ取樣分析的溶液中Fe2+、Fe3+的含量,其目的是確定下一步所加還原劑和氧化劑的所需量。(2分) Ⅲ中所加的還原劑是 Fe 。(1分) 4-2、 Ⅳ中氧化劑通常可用NaClO3,其反應方程式 為6FeSO4 + NaClO3 + 3H2SO4 = 3Fe2(SO4)3 + NaCl + 3H2O(2分) 或用稀硝酸,其反應方程式為6FeSO4 + 2HNO3+ 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O(2分)(正確的離子方程式也可以) 4-3、 Ⅴ所得的產品中Fe3+和SO42- 的物質的量之比不是2:3,為測定Fe3+和SO42-的物質的量之比,所需要加入的試劑是 NaOH 和 BaCl2。(2分) 需要測定Fe2O3(2分)和BaSO4(2分)的的質量(填化學式),測定過程中基 本操作(按順序,填字母)是 B、E、D 。(2分) A、萃取、分液 B、過濾、洗滌 C、蒸發、結晶D、冷卻、稱量 E、烘干或灼燒 第 五題(9分)2004年是俄國化學家馬科尼可夫(V. V. Markovnikov,1838-1904)逝世100周年。馬科尼可夫因提出C=C雙鍵的加成規則(Markovnikov Rule)而著稱于世。本題就涉及該規則。給出下列有機反應序列中的A、B、C、D、E、F和G的結構簡式,并給出D和G的系統命名。(共9分) 答案: (每式1分,每個命名1分,共9分)。(暫缺) D 2-溴-2-甲基丙酸 G 2,2-二甲基丙二酸二乙酯 第六題(14分)(10分)將nmol木炭粉和1mol氧化亞鐵在反應器中混合,隔絕空氣加強熱。 ⑴可能發生的化學反應有 ① Fe+C=Fe+CO↑ ② 2FeO+C=2Fe+CO2↑ ③FeO+CO=Fe+CO2↑ 和 ④ C+CO2 = 2CO (1分) ⑵若n<1/4,反應后,反應器中的固體物質是FeO和Fe(1分) ,氣體產物是CO 2分) ⑶若n<4,充分反應后,反應器中的固體物質是C和Fe(2分),氣體產物是CO(2分)。 ⑷若反應的氣體產物是混合物,n的取值范圍是。 1/2<n<="" p=""></n ⑸若反應的氣體產物是混合物,且混合物中CO和CO2的物質的量相等,則n的值為2/3 (3分)。 第七題(10分)(9分)現有等物質的量的NaHCO3和KHCO3的混合物ag與100mL鹽酸反應。題中涉及的氣體體積以標準狀況計,填空時可以用帶字母的分式表示。 (1)該混合物中NaHCO3和KHCO3的質量比為 84∶100(1分) 。 (2)如碳酸氫鹽與鹽酸恰好完全反應,則鹽酸的濃度為 5a/46(2分) mol·L-1 (3)如鹽酸過量,生成CO2體積為 22.4a/92或5.6a/23(2分) L。 (4)如果反應后碳酸氫鹽有剩余,鹽酸不足量,要計算生成CO2的體積,還需知道鹽酸的物質的量濃度(2分) (5)若NaHCO3和KHCO3不是以等物質的量混合,則ag固體混合物與足量的鹽酸完全反應時生成CO2的體積(V)范圍是 22.4a/100 < V < 22.4a/84(3分) 第八題(10分)1mol丁烷(氣)與不足量的氧氣共貯于一固定容器中,壓強為p,點火燃燒后,回到室溫,得到水若干(其體積可不計)和CO2和CO兩種氣體,總壓強降為0.557p,試求: (1)生成的水的質量;(2分) (2)反應前氧氣的物質的量;(3分) (3)反應后氣體中CO2和CO的物質的量;( 5分) (1)根據C4H10→5H2O,可知1mol C4H10生成5mol水,即90g。 (2)反應后和反應前的壓強之比即為氣體的物質的量之比,設反應消耗氧氣的物質的量為y,則 P前/P后 = 4/(1+y) = 0.557,y=6.18mol。 (3)燃耗后氣體物質的量減少:1+6.18-4=3.18mol,設生成CO2的丁烷為amol,生成CO的丁烷為(1-a)mol,則有: C4H10+6.5O2→4CO2+5H2O Δn 1 6.5 4 3.5 a 3.5a C4H10+4.5O2→4CO+5H2O Δn 1 4.5 4 1.5 1-a 1.5(1-a) 由題意:3.5a +1.5(1-a)=3.18 解得:a=0.84mol 即丁烷有84%轉化為CO2,16%轉化為CO,它們的物質的量分別為:n(CO2)=4×84%=3.36mol,n(CO)=4×16%=0.64mol。 (評卷時考慮有效數字) 第九題(12分)現有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物質的量之和為0.1摩,在此溶液中加入90毫升4摩/升的NaOH溶液,使其充分反應.設Al3+物質的量與總物質的量的比值為x. (1)根據反應的化學方程式計算x=0.4時,溶液中產生的沉淀是什么?物質的量有多少? (3分) 按反應 Fe3+ + 3OH- = Fe(OH)3↓ 0.1-0.4×0.1 3×0.06 =0.06摩 =0.18摩 0.06摩 Al3+ + 4OH- = AlO2- + 2H2O 0.4×0.1 4×0.04 n(OH-)過量(可計算) ∴有0.06摩Fe(OH)3沉淀 (2)計算沉淀中只有Fe(OH)3的x取值范圍. (4分) 請在下圖中畫出沉淀總量(摩)隨x(0→1)變化的曲線。(暫缺) x的最大取值為 0.1(1-x)×3+0.4x=0.09×4,x=0.6 ∴在0≤x≤0.6時,沉淀只有Fe(OH)3 x=0時,Fe(OH)3沉淀量為0.1摩, x=0.4時,Fe(OH)3沉淀量為0.06摩, x=0.6時,Fe(OH)3沉淀量為0.04摩, 在0.6≤x≤1內,總沉淀量: n總=0.1(1-x)+0.1x=0.04摩 (3)若Al3+和Fe3+物質的量之和為A摩(A為合理數值),其他條件不變時,求沉淀中同時有Fe(OH)3、Al(OH)3的x取值范圍和各沉淀的物質的量(用含有A、x的式子表示). (5分) ( 0.36/A -3) < X <= 1 Fe(OH)3 A(1-X) Al(OH)3 A(3+X) -0.6
更多精彩資訊請關注查字典資訊網,我們將持續為您更新最新資訊!
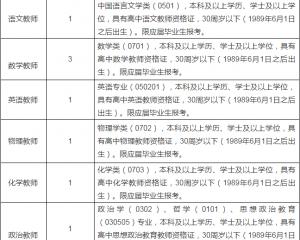 江西師范大學附屬中學2020年招聘教師2020-06-24
江西師范大學附屬中學2020年招聘教師2020-06-24 上海公務員考試《行測》通關模擬試題及答案解析【2019】:952020-06-12
上海公務員考試《行測》通關模擬試題及答案解析【2019】:952020-06-12 上海公務員考試《行測》通關模擬試題及答案解析【2019】:632020-06-12
上海公務員考試《行測》通關模擬試題及答案解析【2019】:632020-06-12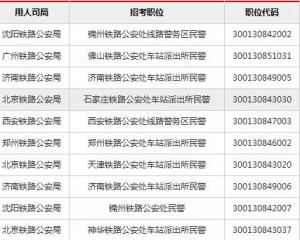 2019國考報名人數統計:鐵路公安系統過審超6萬 競爭力度較高【截至29日16時】2018-10-31
2019國考報名人數統計:鐵路公安系統過審超6萬 競爭力度較高【截至29日16時】2018-10-31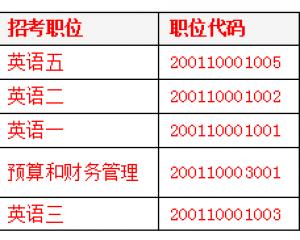 2019國考報名外交部過審3萬余人 平均7人爭一職2018-10-31
2019國考報名外交部過審3萬余人 平均7人爭一職2018-10-31